Wolff–Kishner-黄鸣龙还原反应
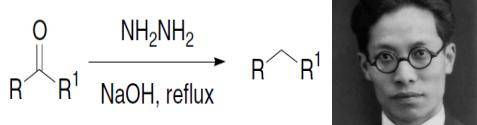
1946年,黄鸣龙基于Wolff-Kishner反应的基础上进行了改进,开发出了一种有机还原反应。这个反应以中国人名字命名,是第一个以中国人名字命名的有机反应,因此为人所知。该有机还原反应能够将羰基化合物在高沸点溶剂(如一缩二乙二醇)中与肼和氢氧化钾一起加热反应,从而将羰基还原为亚甲基。
黄鸣龙改进后的反应不需要封管,而是在常压下进行,先将反应物与氢氧化钠、肼和高沸点醇类的水溶液混合加热生成腙后,将水和过量的肼蒸出,升温回流数小时后即可完成反应。相比于Wolff-Kishner反应,黄鸣龙改进后的还原反应操作更加简单,反应条件也更加宽松,因此原料价格降低,产率提高,能够在工业上进行大规模生产,并在国际上被广泛应用。
史一安不对称环氧化
史一安教授曾担任中国科学院化学研究所化学生物学研究中心主任、中国科学院分子识别与功能重点实验室主任、中国科学院化学研究所学术委员会副主任等职务。他在Chem. Rev.、Acc. Chem. Res.、PNAS、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.等重要期刊上发表了100多篇论文,被引用5000余次,获得了多项重要学术奖励和荣誉。
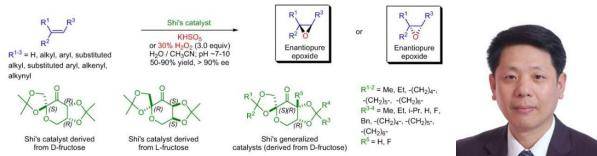
在果糖衍生的手性酮催化下,反式二取代的烯烃或三取代的烯烃利用Oxone作为氧化剂进行不对称环氧化反应。该反应的一个显著特点是利用了有机催化剂。该反应最初由著名化学家史一安教授报道,因此被称为史氏不对称环氧化反应(Shi asymmetric epoxidation)。该反应是目前以中国人命名的有机反应中影响力和认可度最高的反应之一。
张绪穆烯炔环异构化反应
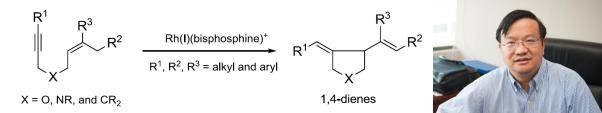
在铑催化剂的催化下,1,6-烯炔类化合物可以高区域选择性地进行不对称环化异构化反应,生成五元杂环化合物。该反应可以方便地实现烯烃和炔烃分子内的不对称环化,高效地构筑一系列五元杂环化合物,在生物活性分子以及药物分子的合成中具有重要的应用。2000年,张绪穆的课题组报道了首例手性铑催化剂催化的1,6-烯炔类化合物不对称环化异构化反应。该反应体系中的催化剂是由中性的铑催化剂[Rh(COD)Cl]2与手性配体经银盐活化后制得。
2014年3月,张绪穆教授的研究成果“烯炔的环异构化反应”被冠以“张”姓,名为“Zhang enyne cycloisomerization”。该成果已被国际化学权威著作Name Reactions收录,成为为数不多的以中国人名命名的人名反应之一。该反应具有广泛的适用性和实用性,利用该反应可以方便地实现烯烃和炔烃分子内的不对称环化,高效地构筑了一些列五元杂环化合物,在生物活性分子以及药物分子的合成中具有重要的应用。例如,世界著名的有机化学家K. C. Nicolaou教授就利用张绪穆教授发展的人名反应实现了几种复杂活性分子的全合成。
Roskamp-Feng反应
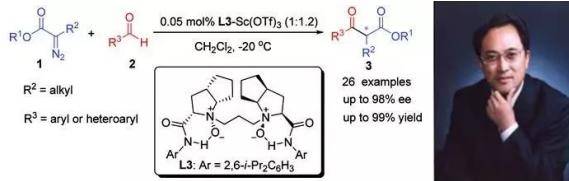
1989年,Roskamp首次报道了利用氯化亚锡催化乙基重氮乙酸乙酯和醛反应制备β-酮酯的反应【J. Org. Chem., 1989, 54, 3258】。随着时间的推移,经过20多年的发展,各种路易斯酸(如Sc(OTf)3,BF3,GeCl2)都可以用于此反应。2011年,四川大学化学学院的冯小明教授以手性氮氧–Sc(OTf)3络合物催化剂实现了首例催化不对称Roskamp反应。
他设计合成的具柔性直链烷基链接的C2对称双氮氧酰胺化合物是一类新型的全能型“优势手性配体”。在路易斯酸和手性配体的催化下,重氮乙酸乙酯和醛伴随着氢的迁移和N2的离去,生成手性β-酮酯。这个反应被称为Roskamp-Feng反应,并被收录于Elsevier公司2011年出版的《Organic Syntheses Based on Name Reactions》(第三版)中,同时也是首个中国科学家在中国本土所做的工作被冠以中国人名的反应。
陆熙炎环化反应
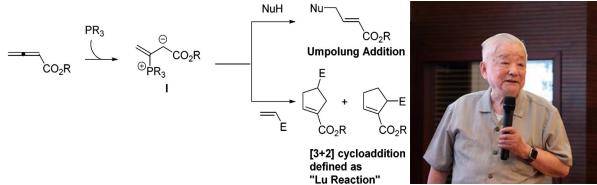
陆熙炎是中国著名有机化学家,1991年当选为中国科学院院士。该反应是陆院士在1995年发展的一种环化反应,它是联烯与烯烃在有机膦的催化下,通过[3+2]环化得到五元环化合物的反应。1988年,陆熙炎院士小组首先报道了一个钌(II)催化下炔酮异构化为共轭二烯酮的反应,反应生成的产物为E,E 构型。其后Trost小组(钯催化)和Inoue小组(钌催化)也分别报道了此类反应。
陆熙炎小组在后续研究中发现,铱(III)【IrH3(i-Pr3)2】催化性能更好。另外加入催化量的叔膦,可以将反应温度降低至35℃。利用铱-三丁基膦作为催化剂,陆熙炎小组在80℃下实现了炔酸酯的异构化反应。另外单独的三烷基膦或三芳基膦可以催化此反应【J. Am. Chem. Soc., 1992, 114 (20), pp 7933–7935】。2006年,Gregory C. Fu教授发表在《Angew. Chem. Int. Ed.》的一项研究中使用了该反应,并提出叫做Lu's [3+2]环化反应。
俞氏糖基化反应(Yu Glycosylation)
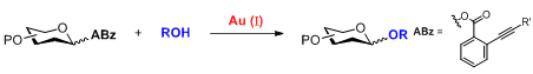
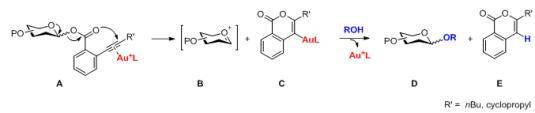
自1893年Fisher糖基化反应被建立以来,已经开发了许多种不同类型的糖基化反应,用于糖苷键的构建。然而,目前大多数的糖基化反应都需要使用化学计量的酸、酸酐或者Lewis酸的促进剂,而非催化量的促进剂的糖基化反应体系本身具有较强的酸性或反应体系中会有H+的聚集,使得合成不稳定的糖苷键具有非常大的挑战性。
2008年,上海有机所俞飚研究员课题组开发了一种新型的糖基化方法,该方法通过使用Au(I)络合物(如Ph3PAuOTf、Ph3PAuNTf2)对邻炔基苯甲酸酯供体进行高效的活化。离去基在活化过程中可以有效捕获反应中产生的H+,从而使得反应体系一直保持在较为温和的条件下。这种新型糖基化反应具有反应条件十分温和、仅需要催化当量的活化剂、底物适用范围广的特点,对一些在其他糖苷化条件下不稳定的底物有较好的耐受性和选择性。目前,这种合成方法已被广泛应用于各种寡糖以及复杂天然产物的合成中,例如Tunicamycin V、Spinosyn A、Mannopeptimycins和Trioxacarcin C等。这种新型的糖基化合成方法被称作俞氏糖基化反应(Yu Glycosylation)。
麻生明氧化反应
2011年,麻生明院士团队便使用Fe(NO 3 ) 3 ·9H 2 O /TEMPO催化体系,O 2 作为氧化剂,NaCl作为添加剂,室温条件下可将联烯丙基醇、炔丙基醇选择性氧化为醛,部分烯丙基醇、苄醇甚至脂肪醇也适用于这种反应体系【Adv. Synth. Catal . 2011, 353, 1005-1012 】。后将助催化剂TEMPO换作更为低廉的4-OH-TEMPO,更适合大规模生产的工艺流程。
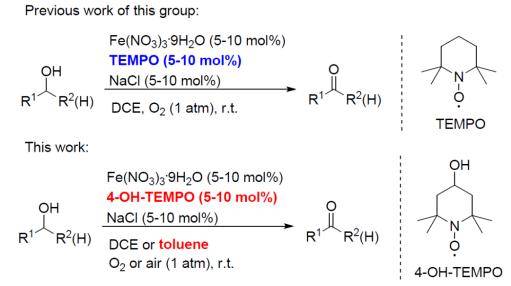
2016年,麻生明院士团队发现月桂醛在类似的反应条件下(将氯化钠换成氯化钾),可高效转化为月桂酸。因此又开发出了新的方法,可以直接氧化伯醇得到羧酸【 J. Am. Chem. Soc. 2016, 138, 8344-8347】。此方法不仅适合脂肪醇,芳香甲醇与炔丙醇也可顺利氧化为相应的羧酸,复杂结构的醇类天然产物分子也可利用该方法进行后期修饰。
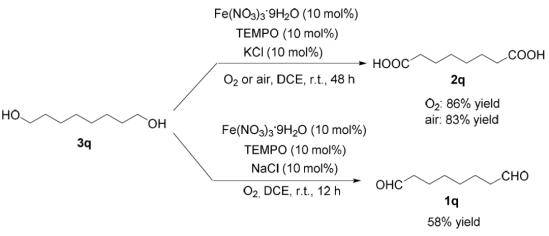
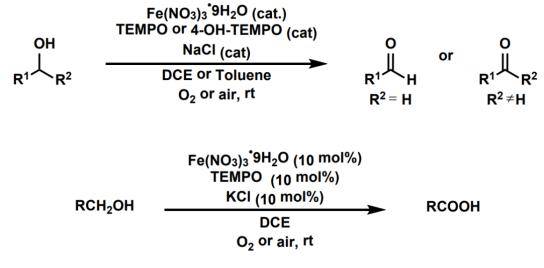
利用Fe(NO3)3·9H2O,TEMPO(及其衍生物)作为催化剂,O2(空气)作为氧化剂,以NaCl作为添加剂将醇氧化为醛酮,或者以KCl为添加剂将伯醇氧化为羧酸的反应,被称为麻生明氧化反应。
Stork-赵康烯化反应
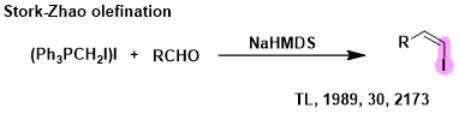
Stork-赵康烯化反应是一个以我国科学家赵康命名的反应。这个反应是对wittig反应的拓展,用于合成(Z)-乙烯基碘-交叉偶联反应的的重要前体,也就是利用(碘甲基)三苯基碘化鏻和NaHMDS反应得到磷叶立德,接着和醛反应得到(Z)-乙烯基碘,其可以作为交叉偶联反应的的重要前体,这使得这个反应在合成(Z)-烯烃时非常有价值。
陈庆云试剂

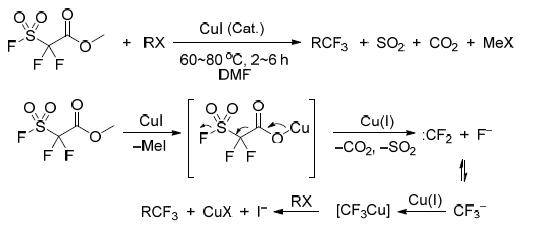
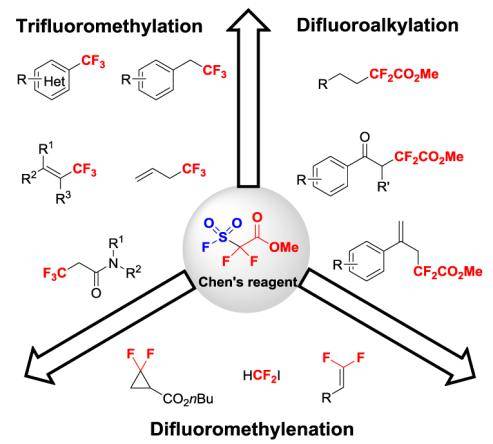
1989年,陈庆云和吴生文在研究FSO2CF2COOMe与亲核试剂 (如KI、KBr、KSCN、胺等) 反应生成二氟卡宾的反应时,意外地发现生成了氟仿 (CF3H) 。他们发现氟仿的生成意味着二氟卡宾与氟离子结合生成CF3-是一个平衡反应。这启发他们思考是否可以利用三氟甲基负离子与亲电试剂反应,将三氟甲基引入到各种有机分子中。通过反应条件的调控,他们发现在催化量的碘化亚铜 (CuI) 作用下,陈庆云试剂可以实现各类卤代物的三氟甲基化反应,在温和条件下高产率地得到一系列含有三氟甲基的化合物。这也是第一例铜催化的有机卤代物的三氟甲基化反应。
进一步研究发现,反应中释放出了SO2、CO2和MeI,这也印证了反应是经过了二氟卡宾中间体和氟负离子结合生成三氟甲基负离子的过程。在碘化亚铜催化下,FSO2CF2COOMe分解产生二氟卡宾,二氟卡宾再与氟离子结合形成三氟甲基负离子,经一价铜稳定,形成活性三氟甲基铜(CF3Cu),最后对各种卤代物发生亲核三氟甲基化反应。该反应也可以不用碘化亚铜引发,而改用铜粉(Cu),通过自由基机理引发也可以实现三氟甲基化。也就是说,在不同条件下,陈庆云试剂实现三氟甲基化可能经历不同的反应途径。最近的研究表明,使用催化量的氯化铜(CuCl2)也能引发FSO2CF2COOMe的三氟甲基化反应。
马大为铜/草酰二胺催化偶联反应

上海有机化学研究所马大为课题组开发了催化Ullmann反应的氨基酸和草酰二胺两代配体,突破了反应条件苛刻和普适性差的局限。该反应已广泛应用于新药研发和新材料创制,应用超过1500次,其中包括两个临床实验药物的百公斤级生产,以及抗高血压药物培朵普利和治疗干眼病药物Xiidra的吨级生产。700余项美国专利利用这一改进的Ullmann反应设计了合成路线。马大为研究员因在这一有机化学领域的卓越贡献,荣获了美国化学会2018年Arthur C. Cope学者奖,并被授予2019年度中国科学院杰出科技成就奖。
高效草酰二胺配体具有以下显著特点:(1)突破了此前铜催化的不活泼的芳基氯代物的偶联反应的局限;(2)对于较活泼的芳基碘代物和溴代物,可以使反应在低催化剂量和更为温和的反应条件下进行。下面将简要介绍相关配体的研究进展。
图片、文章来源:中国科学院、中国科学院上海有机化学研究所、中国科学报、百度百科、有机合成、摩熵化学,如有侵权,联系删除。






